Charcot肩神经性关节病



临床病史
一名32岁男性到骨科就诊,主要诉求是右肩畸形的评估。病史显示,肿胀最初是在9个月前被注意到。体格检查发现右肩带无痛性肿胀,无红斑。关节活动范围虽然无痛,但各个方向都严重受限。
影像学表现
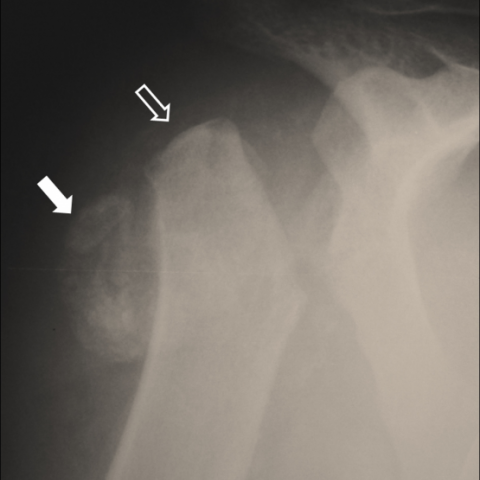
实验室检查结果均在正常范围内,且患者不记得近期或远期的创伤事件。普通X线(Fig. 1)显示肩关节紊乱,可见肱骨头被吸收,以及伴随软组织骨化。鉴别诊断包括炎性关节炎(如CPPD和痛风)、感染性病变(如化脓性关节炎、骨髓炎)以及骨肿瘤。患者始终无症状,且无临床或实验室方面的炎症或感染证据。 随后进行的MDCT检查(Fig. 2-3)证实肱骨头“截断”,并在冈下—肩峰下滑囊和腋窝囊内发现骨化碎片。之后的MRI(Fig. 4)显示显著的滑膜增生和增厚、关节及滑囊积液、关节内碎屑以及无骨髓水肿的证据。结果尚不明确,因此将患者转诊进行CT引导下活检(Fig. 5)。在活检过程中,患者对多次针刺无任何疼痛反应,即使在未先行利多卡因浸润的区域也是如此。组织学检查未发现恶性证据。 结合患者无特殊病史,以及临床、实验室、组织学和影像学检查结果,提示诊断为Charcot神经关节病。随后对脊柱进行额外MRI检查(Fig. 6),证实存在脊髓空洞症这一潜在的原发疾病。
病情讨论
神经性骨关节病(neuropathic osteoarthropathy),又称神经性营养不良性关节(neurotrophic joint),最早由W. Musgrave于1703年首次描述。随后在1868年,J.M. Charcot首次报道了相关发现并提出了病因学观点,因此得名Charcot神经关节病-骨关节病(Charcot neuroarthropathy-osteoarthropathy)。目前,关于神经性骨关节病的病理生理机制主要有两大理论。神经血管理论认为自主神经病会导致骨血液灌注增加,从而提高破骨细胞活性并导致骨质减少。此后,脆弱骨骼的病理性骨折会引发严重的关节破坏和畸形。神经创伤理论则认为本体感觉的丧失是潜在因素。感觉缺失导致对损伤缺乏保护性反应,最终反复的微小创伤造成关节破坏。第三种比较新的理论则兼顾上述病因机制,并得到了部分学者的支持。 此外,分子生物学的进展表明,骨代谢的调控会受到神经系统的影响。已经鉴定的一系列神经递质包括谷氨酸、降钙素基因相关肽(CGRP)、P物质、血管活性肠肽(VIP)、垂体腺苷酸环化酶活化多肽(PACAP)、瘦素以及儿茶酚胺等,这些发现确立了神经组织在调节骨稳态中的作用,因此可能存在基于分子层面的解释。尽管病因及发病机制尚不明确,但已知多种疾病与神经性骨关节病有关,包括糖尿病、脊髓空洞症、脊髓痨(梅毒)、脊髓肿瘤、脊髓损伤、多发性硬化、脊髓灰质炎、麻风以及先天性或家族性痛觉缺失综合征等。糖尿病患者尤其容易发生足和踝关节的神经性关节病,这是目前该病最常见的部位。本例为脊髓空洞症导致的骨关节病。据我们所知,目前文献中虽然有肩部Charcot关节病的报道,但尚未有利用容积重建MDCT重组技术对该病的完整展示。总之,Charcot关节病可能会与侵袭性疾病如感染(骨髓炎和/或化脓性关节炎)以及肿瘤或关节内沉积性炎症疾病(如CPPD和痛风)相混淆。事后来看,如果能更加全面地评估所有临床、体格、实验室及初步影像学结果,本例实际上本可避免进行CT引导活检。
鉴别诊断列表
最终诊断
Charcot肩关节神经病性关节病
证书
(无内容可翻译)
图像分析
X线
CT(计算机断层扫描)

VRT图像



核磁共振成像


CT引导活检

脊柱磁共振成像

医学影像分析报告
1. 影像学发现
根据提供的X线、CT及MRI图像,可见右侧肩关节区域存在明显的关节结构破坏和畸形变化,表现如下:
- 肩关节面不规则,关节间隙明显变窄或模糊,局部可见骨质破坏、碎裂以及骨赘样增生。
- 肱骨头形态破坏明显,边缘可见不规则碎片;肩胛盂亦有不同程度的改变。
- CT的容积重建显示关节轮廓严重变形,关节面明显错位,呈现“崩塌”样改变。
- MRI可见软组织肿胀较轻,关节周围无明显明显感染信号征象;肩部软组织结构(如肩袖)部分撕裂或退变信号。
- 结合颈椎及上胸段MRI可见脊髓内空洞(脊髓空洞症),提示病理性神经损害。
整体影像表现与疼痛不成比例(患者主诉疼痛轻或完全无痛),进一步提示“神经病性关节病变”。
2. 潜在诊断
结合患者基础病史(无明显急性外伤史、无糖尿病等常见病因,但伴随脊髓空洞症)以及影像学特点,可能的诊断及鉴别诊断包括:
- 神经病性关节病(Charcot关节):
- 与患者存在神经功能缺损相对应,临床上常见于糖尿病、脊髓损害、麻风、脊髓空洞症等。
- 影像学上常表现为进行性、毁坏性关节破坏,且患者痛感明显减弱或缺失。
- 感染性关节病(如骨髓炎、化脓性关节炎):
- 通常有剧烈疼痛、红肿热等急性炎症表现,血液学检查可见白细胞增高、炎性指标升高。
- 影像上也可出现骨质破坏,但多伴明显软组织肿胀、脓肿或窦道形成。
- 结晶性关节炎(如痛风、CPPD):
- 成人常见,急性发作时伴有关节明显红肿热痛,慢性期可有关节破坏。
- 影像学常见特点为局部软组织肿胀、特征性结晶沉积等。
- 肿瘤或肿瘤样病变:
- 包括骨肉瘤、转移瘤或其他局部肿瘤性侵犯。
- 通常影像上可见偏心溶骨或成骨病灶,或局部软组织包块。
以上鉴别诊断中,患者的无痛性关节破坏以及脊髓空洞症史最支持神经病性关节病。
3. 最终诊断
结合以上影像学特征(严重而无痛的关节结构破坏)、患者临床表现(长期无痛性肿胀、活动受限)以及明确的脊髓空洞症病史,可诊断为: “由脊髓空洞症引起的神经病性肩关节病(Charcot关节)”。
目前临床、影像及病理等综合证据均提示此诊断具有高度可靠性,故进一步活检等操作可酌情谨慎选择或避免。
4. 治疗方案与康复计划
4.1 治疗策略
- 保守治疗:
- 主要在于避免关节进一步破坏,必要时可使用支具或肩背带对关节进行保护性制动。
- 控制并改善导致神经病性改变的原发病(如脊髓空洞症)的进展或相关症状。
- 对于关节疼痛较轻的患者,可酌情应用非甾体抗炎药(NSAIDs)或镇痛药物缓解不适。
- 手术治疗:
- 若关节出现严重畸形或影响日常生活,可评估关节融合或关节置换手术,但需谨慎,尤其在神经病性关节病背景下,手术风险较大。
- 手术指征取决于功能需求、疼痛程度,以及神经病变的稳定性。
- 并发症预防:
- 防止继发性皮肤破溃、关节失稳加重、关节周围骨折等情况发生。
- 若合并有其他感染风险,应及时处理潜在感染源。
4.2 康复与运动处方
康复训练的目标在于最大限度地维持或恢复患者的肩关节功能,且避免进一步损害。可遵循FITT-VP(频度Frequency、强度Intensity、时间Time、类型Type、进阶Progression、体量Volume)的原则进行个体化安排:
- 阶段一(急性/亚急性期保护阶段)
- 频度:每周3~5次,短时低强度训练。
- 强度:关节活动度训练从被动活动或助力活动开始,避免过度牵拉、扭曲。
- 时间:每次5~10分钟,逐步累计。
- 类型:关节柔韧性练习、肩周围肌肉轻度等长收缩练习。
- 注意事项:佩戴支具或护具保护关节,监测患者主观不适度。
- 阶段二(功能恢复与强化阶段)
- 频度:每周3~4次训练,可适当延长训练时间。
- 强度:在确保稳定的基础上,缓慢增加关节活动范围及肌力练习强度。
- 时间:每次15~20分钟或根据耐受情况调整。
- 类型:主动活动范围训练、弹力带/轻重量肩部肌群锻炼,配合肩带肌群的稳定性训练。
- 进阶:一旦患者能够完成特定强度练习而不适症状明显,可逐渐增加阻力。
- 阶段三(维持与预防再损害阶段)
- 频度:每周2~3次,长期坚持。
- 强度:维持在中等强度,不追求高负荷。
- 时间:每次20~30分钟,注重动作准确度与控制力。
- 类型:稳定与协调性训练,如闭链训练、肩关节协调运动。
- 进阶:根据关节状态和功能需求,维持或轻度增加训练量。
在整个康复过程中,应严密观察肩关节疼痛或肿胀变化,若出现任何急性不适或功能突发下降,应及时就医。
5. 免责声明
本报告仅基于当前提供的病史及影像资料所做的参考性分析,不可替代线下面诊或专业医生的诊断与治疗方案。任何医疗决策应结合患者实际情况,在专业医师指导下进行。
人类医生最终诊断
Charcot肩关节神经病性关节病