

一名87岁的女性患者在接受包括子宫切除术、45Gy放射治疗(每周分次,5次,每次1.8Gy)以及腔内高剂量率近距离放射治疗(2次,每次5Gy)在内的子宫颈癌治疗后进行随访影像检查时并无症状。实验室检查结果无异常。
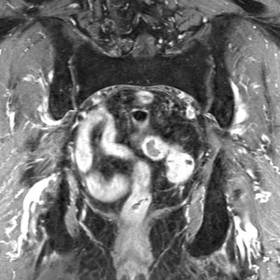
与之前的成像相比,放射治疗后6周的MRI中未见明显的骨信号改变(图1)。治疗后八个月时,可见左骶髂关节(SIJ)附近存在轻微的局灶性及弥漫性钆对比剂摄取,并且在右侧骶髂关节附近的T1w图像上出现了新的斑点状信号改变(图2)。
治疗后18个月,几乎整个骶骨在对比剂注射后于T1w序列上出现大面积的信号增高,其中在骶骨右侧可见中心低信号区和外围高信号(图3a)。同时还可见与左骶髂关节平行的一条细小的低信号线,考虑为疲劳性骨折(图3b)。
治疗后40个月的钆剂增强MRI显示信号改变减轻,同时可见较小的病变,于右侧可见环形高信号边缘及等/低信号中心(图4)。在对比增强后的轴位T1w图像上未见可疑的持续性骨折线。
放射治疗过程中,在健康、未受肿瘤影响的组织中出现的不良反应是常见副作用(Dalinka et al 1985)。对健康骨组织通常相对减弱的辐射最主要的不良事件是放射性骨坏死(ORN)。据文献报道,其发病率在2.1-34%之间(Feltl et al 2006)。放射性骨坏死部分是由血管损伤以及骨重塑细胞(如成骨细胞)受损所导致,这些损伤通常会导致细胞死亡增加(Burgener et al 1991)。血管损伤的程度、成骨细胞活性的降低以及因此而导致的骨坏死风险取决于多种因素。主要原因是治疗相关因素,例如放射方式(外照射和/或近距离放射治疗)、放射治疗的时长和分次、放疗总剂量,以及额外潜在毒性的治疗(如化疗)。同时,个体因素也会影响放射反应的程度,如患者年龄、合并症、已有的骨质减少,以及诸如糖皮质激素等附加用药(Mitchell et al 1998)。
在最常受累的骶骨部位,放射性骨坏死的一种后遗症是进行性生物力学骨不稳定,从而导致疲劳性骨折。疲劳性骨折的程度往往比较轻微(Howland et al 1975)。鉴别其与转移性病变或反应性改变可能比较困难。疲劳性骨折在T1加权图像上通常表现为与骶髂关节(SIJ)平行的细条状低信号。区分良性病变与恶性病变或肿块的重要点在于病变的对称性和分布模式,包括全身及受照射的骨骼区域。转移通常分布不对称,且往往会出现多个病灶,而放射性骨坏死在盆骨放射区更常呈对称性,且常双侧受累(Ugurluer et al 2014)。此外,放射治疗后继发的肉瘤比较罕见,一般会在放疗后许多年才出现。这些病灶会表现出进行性骨破坏。放射性骨坏死在形态学和时间进程上都具有异质性,而且还会受到骨质减少、化疗等风险因素以及非愈合或愈合缓慢的疲劳性骨折等并发症的影响,呈现出个体化差异。通常坏死是自限性的。目前并无统一或指南相关的治疗方式。总而言之,基于上述放射学表现,如对称性,可逆性骨质信号改变的后续表现,以及在放射背景下缺乏转移证据的情况,强烈提示影像学结果符合反应性炎症性骨髓反应、放射性骨坏死、疲劳性骨折及骨重塑增强的综合表现。
愈合中的放射性骨坏死伴继发性不足性骨折


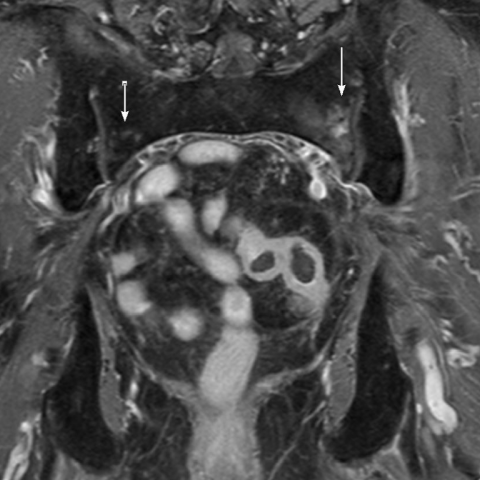





根据所提供的MRI序列图像,可见骨盆区域(主要涉及骶骨、髂骨及周围骨质)存在对称性异常信号改变,表现为:
整体而言,这些影像学改变提示在放射治疗后的骨骼区域出现放射性骨坏死(osteoradionecrosis, ORN)及随之产生的微小或不稳定型骨折(即“损伤性骨折”或“疲劳性骨折”,常称为“insufficiency fracture”)。
结合患者高龄、既往宫颈癌手术及放射治疗史、影像所见的对称性骨质信号改变、局部不完全骨折以及缺乏活动性肿瘤或感染证据,最可能的诊断为:
“放射性骨坏死(osteoradionecrosis)合并骶骨及骨盆不完全骨折(insufficiency fracture)。”
鉴于患者目前并无明显症状、化验指标正常,故建议以放射性骨坏死为主要考虑,密切随访并对症处理。
针对高龄且有放射性骨坏死及不完全骨折风险的患者,核心康复原则是安全、循序渐进和个体化:
在康复过程中需密切监测疼痛、活动能力和行走稳定性。若出现新的疼痛加重或可疑骨折体征,应立即复诊并调整方案。
本报告为基于现有影像与病史资料所作的参考性医学分析,不能完全替代线下面诊或专业医生的诊断与治疗意见。如有任何疑问或症状变化,请及时就医。
愈合中的放射性骨坏死伴继发性不足性骨折