


一名73岁的男性被转诊至内科。他自一年半以来一直主诉无精打采及体能下降。实验室结果显示小细胞性贫血和炎症指标升高。胃镜、结肠镜及骨髓穿刺检查均未发现可疑异常。随后进行了18FDG-PET/CT检查。
双腿 CT 成像显示髓质骨质硬化并伴有皮质增厚,累及骨干和干骺端。在 18FDG-PET 成像(1a, b)中,相应部位可见高 FDG 摄取。胸腹部 CT 成像显示主动脉周围软组织浸润(2a-e),并向左右椎旁间隙扩展(2a-c)。请注意胸骨后(2a)与胸膜的软组织浸润(2b)。肾上腺肿大,并且邻近脂肪组织被软组织浸润。肾上腺、主动脉周围及胃部均可见 FDG 示踪剂摄取增高(2d)。在左右肾周及后腹膜区(“hairy kidney” 征)可见软组织浸润,并扩展至肾窦(2e)。18FDG-PET 成像在大脑中动脉前方可见左侧高代谢灶,以及在足部小骨出现高 FDG 摄取,但 CT 成像中并未见到相应的病灶(3a, b)。
Erdheim-Chester Disease(ECD)是一种病因不明的罕见多系统性疾病 [1, 2]。其特征是在影像学上出现典型的骨浸润模式,并伴有不同程度的骨外受累 [3, 4]。最常见的症状包括骨痛、尿崩症、突眼、肾血管性高血压或神经系统表现 [4-6]。
骨浸润通常表现为长骨干骺端和干骺段对称的双侧骨硬化 [2, 3, 5]。其他放射学特征包括溶骨、皮质增厚、骨髓腔变窄、皮质与髓质界限模糊、干骺端透亮带以及骨膜炎的征象。在MR成像上,骨硬化在T1加权图像上呈低信号,在T2加权图像上呈高信号;并在钆剂注射后增强 [3]。
肾周及肾后腹膜间隙的双侧软组织浸润被称为“hairy kidney”征。该征象在CT成像上表现为均匀的带状结构,边缘呈刺状;在T1和T2加权MR成像上与肌肉等信号 [2, 4]。浸润可延伸至肾上腺窝 [4, 5]。主动脉弥漫性环绕受累被称为“coated aorta”,在CT成像上表现为低密度,在T1和T2加权图像上与肌肉等信号 [2, 4]。心脏受累表现为心包软组织增厚、心包积液或心肌假肿瘤样包块。在高分辨率CT成像上可见平滑的间隔增厚、小叶中心结节或胸膜增厚 [2, 4, 5]。眶后软组织受累通常位于肌锥内,为双侧性,在T1和T2加权MR成像上无明显信号。下丘脑-垂体轴受累在T1加权MR成像上可表现为垂体柄内的结节状肿块,或在垂体后叶缺乏正常信号 [5]。神经系统受累可表现为脑、脑膜或脊髓内的结节或肿块,在T2加权MR成像上信号增强,并在T1加权MR成像钆剂注射后可见持续性强化 [6, 7]。
99mTc骨显像和18FDG-PET/CT成像的优势在于可进行全身检查 [3, 8]。99mTc骨显像可显示所有骨病变的放射性示踪剂摄取增高,并能检测放射学上未表现的骨受累 [3]。18FDG-PET/CT成像可显示所有代谢活跃病变的FDG显著摄取 [8]。
ECD的诊断依据影像学所怀疑,并通过活检的组织学分析得以证实。总体而言,预后不良,可用的治疗方案有限。内科治疗包括皮质类固醇、双膦酸盐、细胞毒性药物以及免疫抑制剂 [2, 5]。当肿块压迫脑干或脊髓时,可行手术干预 [6]。
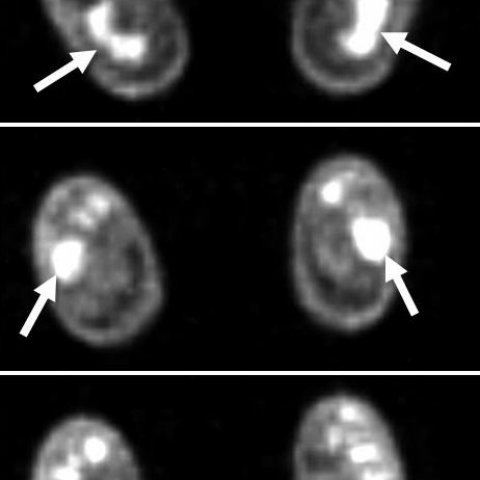
骨活检证实了Erdheim-Chester病的诊断。








患者为73岁男性,主诉乏力及身体机能衰退1年半。血液学检查提示微小性贫血及炎症指标增高。消化道内镜及骨髓穿刺并无明显异常。在进行全身18F-FDG PET/CT以及相应的CT检查后,影像所示以下主要特征:
1. 双侧长骨(胫骨、股骨)的干骺端出现对称性硬化改变,可见骨皮质增厚,部分区域模糊,可疑髓腔狭窄。
2. 骨显像或PET/CT上,可见骨骼病灶呈高代谢活性。
3. 软组织层面可见环绕大血管的软组织带状阴影(在心包、主动脉周围等部位有相关软组织浸润),与“包覆主动脉(coated aorta)”征类似。
4. 双肾周围可见带状软组织密度影,似“多毛肾(hairy kidney)”征。
5. 部分患者可出现垂体柄异常或颅内(如鞍区、脑膜)占位征象,PET/CT可见相应部位轻中度放射性摄取增高。
这些表现符合典型的全身性组织增殖与浸润过程,多处骨骼与软组织的同步受累提示系统性疾病。
结合上述影像学改变与患者的临床病史,可能的诊断包括但不限于:
1. Erdheim-Chester病(ECD):罕见的非朗格汉斯细胞组织细胞增殖性疾病。典型影像学表现包括长骨对称性硬化改变、“包覆主动脉”征、“多毛肾”征以及多系统受累。
2. 朗格汉斯细胞组织细胞增殖症(LCH):与ECD同属组织细胞增殖性疾病,但LCH更多累及颅骨、肺、皮肤等部位,且常见于更年轻的患者。
3. 多发性骨髓瘤:一般表现为溶骨性或混合性骨破坏,可伴有骨痛、贫血、高钙血症及肾功异常。但本例骨质硬化为主,且冷(或热)病灶模式与多发性骨髓瘤不完全匹配。
4. 代谢性骨硬化疾病(如严重的骨质硬化症系列):一般缺乏周围软组织及内脏浸润表现,且无明显增高的炎性指标或肾功能异常。
基于以上综合分析,Erdheim-Chester病最具特征性,其他诊断需结合组织病理或更多临床证据加以排除。
在综合患者的年龄、症状、影像检查结果以及排除其他常见疾病后,最可能的诊断为Erdheim-Chester病(ECD)。
由于ECD诊断的最终确立通常还需要经过病理活检(如骨病灶或受累软组织病灶的活检),建议尽快安排穿刺或手术取样,以明确组织学证据。如果已取得组织病理证实,则可确认ECD诊断。
针对Erdheim-Chester病的治疗一般包括以下方面:
1. 药物治疗:
- 糖皮质激素:常用于缓解炎性过程,可控制症状;
- 双膦酸盐:帮助控制骨骼病变,缓解骨痛;
- 免疫抑制剂或细胞毒性药物:对于病情进展迅速或重要器官受累严重者,可酌情使用;
- 干扰素或其他靶向药物:在部分病例报道中可获得一定疗效。
2. 手术/介入治疗:
对危及生命或有严重压迫症状的病变(如脊髓、脑干受压),可考虑减压手术或病灶切除;必要时可给予放射治疗作为辅助。
3. 康复与运动指导:
- 康复原则:ECD患者常伴骨质改变、心肺功能影响及全身性疲乏。宜采用个体化、循序渐进的运动处方;
- 运动形式:可选择低冲击性有氧运动(如步行、健身车、游泳),并结合低负荷阻力训练(小哑铃/弹力带训练);
- FITT-VP原则示例:
• 频率(Frequency):每周3~5次;
• 强度(Intensity):根据患者自觉疲劳程度,宜维持低中等强度(对心率、血压、呼吸尚可耐受);
• 时间(Time):每次有氧运动约20~30分钟为宜,阻力训练单次8~12个重复,2~3组;
• 方式(Type):交替进行有氧训练与轻度阻力训练;
• 渐进(Progression):密切监测患者对运动负荷的耐受度,逐步提高训练时间或轻微加大阻力。
• 体量与阶段性目标(Volume & Progression):根据患者日常体能改善和主观感受,阶段性调整目标。
- 注意事项:避免高冲击、过度负重或带来骨折风险的训练方式;若出现明显骨痛、气促或心率异常,应适当降低强度或暂停,并及时评估。
免责声明:
本报告基于提供的影像与病史信息,旨在提供参考性医学分析,不能替代线下面诊或专业医生的诊疗意见。具体诊断与治疗方案应结合患者实际情况,由专科医生综合评估后确定。
骨活检证实了Erdheim-Chester病的诊断。