多灶性上皮样血管内皮瘤



临床病史
一名41岁的男性因左腿出现疼痛性肿块而就诊。值得注意的是,他在15年前曾发生左侧胫腓骨骨折,并接受了手术治疗。
影像学表现
进行了 X 线、CT 和 MRI 检查,并在超声引导下(Fig. 3)进行活检以确认诊断。随后又进行了胸腹部 CT。
X 线和 CT 显示,与螺旋形骨折相关的骨折内固定材料,以及累及胫骨前方、伴有骨皮质破坏和软组织肿块的溶骨性病变。未见骨膜反应或矿化基质。肿瘤内部可见钙化的小梁,呈“肥皂泡”样外观(Fig. 1 和 2)。
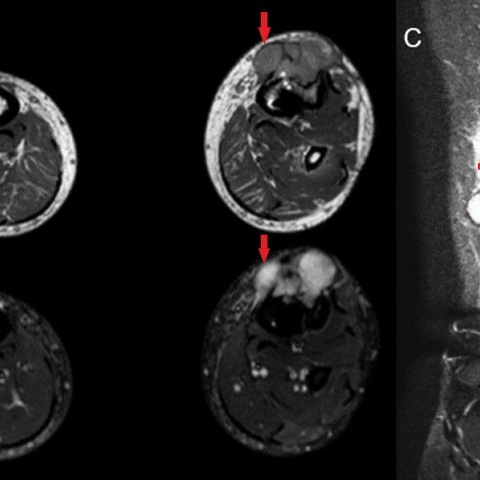
MRI 显示肿瘤向软组织明显扩展,边缘呈分叶状,整体信号均匀,只有在分隔处例外(Fig. 4)。对肿瘤进行活检后,结果显示恶性肿瘤性增生,由上皮样细胞构成,免疫组织化学标记与上皮样血管内皮瘤相符合(Fig. 5)。此后又进行胸腹部 CT 检查,显示左髂骨存在另一类似病变(Fig. 6)。
病情讨论
恶性骨血管肿瘤非常罕见,<1% 的原发性恶性骨肿瘤。
上皮样血管内皮瘤(EHE)是一种血管肿瘤,恶性程度介于血管瘤和血管肉瘤之间,具有较高的局部复发率和转移潜能 [1, 2]。Weiss 等人于 1982 年首次将其描述为可同时累及骨和软组织的血管性新生物 [3]。在骨中,EHE 多位于下肢的干骺端或(较少见的)骨骺区 [2, 3, 4]。几乎可见于任何年龄(尤其在第 2-3 个十年),男性略多于女性 [4]。患者通常主诉患处疼痛和肿胀。约 50% 的病例为多灶性病变(同一骨内多发病灶或多骨受累)。
X 线检查通常显示皮质或髓腔扩张性溶骨性病变,无基质矿化。钙化并不常见,若无病理性骨折,则很少出现骨膜反应。皮质破坏、软组织以及关节受侵均可出现 [2]。已有人描述出现“肥皂泡”样表现 [5]。
在 MRI 上,EH 在 T1 加权图像上呈低至中等信号强度,在 T2 加权图像上信号较高,注射钆剂后可见均匀强化 [2]。
初步诊断包括成釉细胞瘤和骨纤维性发育不良。由于存在软组织肿块,并不能排除恶性肿瘤,加之另一处类似病变,使我们在 40 岁以上患者中考虑转移瘤和骨髓瘤。
然而,在面对多发性骨病变、无骨膜反应和软组织肿块时,放射科医师必须将血管性肿瘤纳入诊断范围。若能及早怀疑血管性肿瘤,病理科医师就会加入血管内皮细胞特异性标记物(CD31、CD34、因子 VIII)进行检测 [5]。
了解 WHO 2013 年颁布的《骨和软组织肿瘤世界卫生组织分类》第 4 版非常重要。该版对 EHE 的遗传学特征进行了阐述(例如,有报道指出 YAP1-TFE3 易位可定义一亚群,往往影响年轻成人,而 t(1;3)(p36;q23–25) 在所有解剖部位的 EHE 中均可见),并根据肿瘤大小和有丝分裂活性提出了风险分级 [6]。
EHE 的临床病程多变,通常进展缓慢。一些文献报道多灶性病变具有更佳的预后。然而,在最大规模的系列研究中,单发病变的总体生存率为 89%,而多灶性病变则为 50%。
完整的手术切除是首选治疗。其他治疗包括术前栓塞、射频消融以及放疗(可单用或与手术联合使用) [2, 3]。
鉴别诊断列表
最终诊断
多灶性上皮样血管内皮瘤
图像分析
左腿前后位 (A) 与侧位 (B) X 线片

体渲染图像

腿部磁共振成像
组织学

骨盆轴位平扫CT扫描

超声引导下活检

医学影像分析报告
一、影像学发现
基于患者左小腿既往骨折内固定史(可见髓内钉及固定钢板),在X线平片和CT重建图像中,可见左胫骨中下段骨皮质及髓腔内存在多发溶骨性病变,边界相对不规则,部分区段可见骨皮质局部膨隆改变。局部可见“泡沫样(soap-bubble-like)”改变,骨皮质虽有部分破坏但尚未见明显大范围骨膜反应。MRI上,T1加权像信号多呈中低信号,T2加权像信号高,强化扫描后病变部位可见明显强化,提示血供丰富。病变周围软组织层面可见局部肿块影,引起一定程度软组织侵及。
二、潜在诊断
结合患者年龄、左小腿疼痛肿块的临床表现,以及上述影像学所示溶骨性、富血管性特征,以下为主要考虑的诊断或鉴别诊断:
- 1. 血管性肿瘤(尤其是血管内皮来源):如上影像与病理特征提示需要优先考虑血管性肿瘤,包括血管瘤、血管肉瘤或中度恶性的上皮样血管内皮瘤(EHE);
- 2. Adamantinoma:该病多见于胫骨前方皮质,可呈溶骨性病变,但其病理形态与血管肿瘤并不相同;
- 3. 骨纤维性病变(如骨纤维异常增殖症、骨化纤维瘤等):部分病例可见膨胀性溶骨破坏,但往往无明显血管性强化特点;
- 4. 转移瘤或多发骨髓瘤:患者超过40岁,出现多发溶骨性病灶时应考虑转移瘤或骨髓瘤;但若无明显其他系统症状或实验室异常可相对降低此可能。
三、最终诊断
依据影像学表现(多发溶骨性病灶、强化明显、无显著骨膜反应、局部软组织肿块),以及患者已有病理检查提示血管内皮标记物(CD31、CD34等)阳性,综合判断最可能的诊断为“上皮样血管内皮瘤(Epithelioid Hemangioendothelioma, EHE)”。该病为中度恶性的血管性肿瘤,具有局部侵袭及潜在的转移特征,需结合临床症状、实验室及后续的影像学随访,进一步明确病变范围与治疗策略。
四、治疗方案与康复计划
根据目前的诊断及患者情况,治疗的核心策略为手术切除或病灶清除,必要时可考虑辅以其他局部治疗方式。以下为相关建议:
- 手术策略:对孤立性病变或可切除的多灶性病变,尽量行完整病灶清除或广泛切除,并结合内固定或重建以保持肢体稳定;
- 其他治疗:术前可考虑血管栓塞预处理(减少术中出血),部分患者可选择射频消融或放射治疗;
- 术后康复与运动处方(FITT-VP 原则):
- 频率(Frequency):早期每周2-3次康复训练,逐渐过渡到每周3-5次;
- 强度(Intensity):先从低强度的关节活动度和肌力训练开始,如简易抬腿、踝泵运动,再逐步过渡到中等阻力训练,遵循不引起明显疼痛或疲劳为准;
- 时间(Time):每次训练10-15分钟起步,逐渐延长至20-30分钟,根据患者耐受情况调整;
- 方式(Type):前期主要以关节活动度训练、肌肉等长收缩训练为主,配合水疗或使用辅助支具循序渐进。后期可逐步增加有氧运动(如骑车、游泳)和下肢负重练习;
- 渐进性(Progression):随着痛感消退、骨愈合及软组织修复,逐步提高训练强度与时间。切忌过早承重过大或进行大幅度扭转动作;
- 体积与个体化(Volume & Individualization):结合患者疼痛程度、灵活度、骨质及心肺功能,个体化调整运动量与方式,定期随访影像学,防止病变进展或发生骨折。
- 特别注意:如患者术后骨质脆弱或存在潜在全身病变(多部位骨损害),需加强防护及监测,避免跌倒或过度训练。应定期复查影像与实验室指标,评估局部肿瘤控制情况与全身状态。
五、免责声明
本报告仅基于当前所提供的病史和影像学资料进行参考性分析,不能替代线下面诊或持证医师的实际诊疗意见。具体诊疗方案仍需结合患者的临床检查、组织病理学结果及主治医师的综合判断。如有任何疑问或症状变化,请及时咨询专业医生。
人类医生最终诊断
多灶性上皮样血管内皮瘤