腹壁硬纤维瘤



临床病史
一名 31 岁女性患者在右侧腹壁出现无痛、缓慢生长的肿块。触诊发现右侧外腹壁中段可触及一个固定、质地坚硬的肿瘤。患者无创伤、手术或生育史。实验室检查结果无异常。
影像学表现
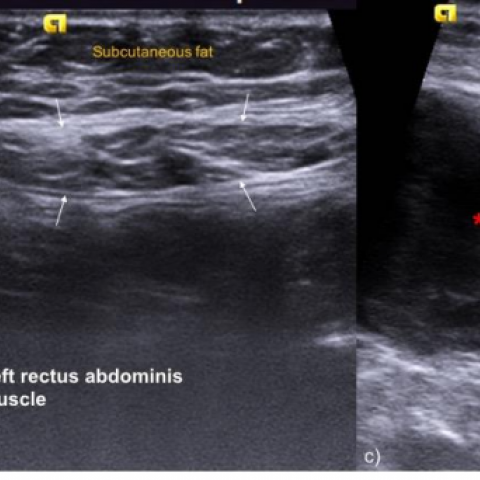
超声(US)是初始筛查的首选方法,显示在右侧腹直肌内一个边界较清晰、异质性低回声的肿块(图1)。多普勒超声检测到血流信号,但结果不明确。
通过计算机断层扫描(CT)进行进一步评估,发现一个边界清晰、轻度强化的软组织肿块来源于右侧腹直肌。肿块内部无钙化或坏死证据。未见侵及邻近腹腔器官的迹象(图2)。
随后进行了超声引导下的粗针活检,结果与硬纤维瘤(desmoid-type fibromatosis)相符合。
在术前检查完成后,患者被安排接受手术。在等待手术期间,肿块出现疼痛性增大,促使于两个月后进行再次CT评估,结果显示肿瘤明显增大,但仍未见腹腔内侵犯(图3)。
患者随后成功接受了完整的肿瘤切除手术,并获得镜下切缘阴性的结果。
病情讨论
硬纤维瘤样纤维瘤(DF),也称为侵袭性纤维瘤病,是一种局部侵袭性肿瘤,但无转移潜能 [1]。这种成纤维细胞性肿瘤较为罕见,占所有软组织肿瘤的比例不到 3% [1]。
根据部位不同,DF 可分为腹膜外型、腹膜内型或腹壁型 [1]。腹壁型 DF 起源于腹壁的肌腱膜结构,最常见于腹直肌或腹内斜肌及其筋膜覆盖处 [3]。
内分泌因素在此类型 DF 中起重要作用,这也解释了为何年轻女性在妊娠期或产后最常受影响 [1]。它们也可能继发于创伤、手术后或与家族性腺瘤性息肉病等遗传综合征相关 [1]。
通常,这些肿瘤表现为单发、缓慢生长、质地坚硬且无痛的肿块 [3]。
在影像学上,DF 往往表现为边界较清楚的实性肿块,其外观因其组织学成分(梭形细胞、黏液基质、胶原基质)的数量和分布不同而有所差异 [1, 2]。
超声(US)是初步筛查可触及腹壁肿块的有用影像学方法。超声上表现为椭圆形软组织肿块,回声可有变化 [3]。DF 可出现筋膜尾征(fascial tail sign),反映沿筋膜平面的细丝状线性延伸,以及鹿角征(staghorn sign),提示肿瘤在肌肉内的指状延伸 [1, 2]。彩色多普勒超声下血流信号可有不同 [1]。
在 CT 上,腹壁 DF 的密度不一,可与骨骼肌相似或稍高 [1, 2]。在较大的肿块中,可能见到更不均匀的表现。坏死或钙化非常罕见 [1]。大多数此类肿瘤表现为轻至中度强化 [1]。
在 MRI 上,DF 通常呈现出异质性信号特征,早期 T2 加权像信号偏高,但随着肿瘤演变(胶原沉积增多),T2 信号会降低 [1, 2]。常见描述的非强化线样带(带征)可能对应致密胶原基质 [1]。
尽管存在典型的影像学表现,但仍需通过组织病理学分析进行确诊 [3]。然而,CT 和 MRI 是评估可切除性、手术规划和随访的最佳影像学检查方法 [3]。对手术有重要影响的影像学发现包括肿瘤在纵向和深度方面的范围、是否累及内脏器官、以及与肋软骨连接处或下缘肋骨的关系 [1]。
对于进行性或有症状的肿瘤,手术是首选治疗,而对于未造成明显功能障碍的肿瘤,可以采取保守治疗 [3]。
腹壁 DF 手术切除后,当地复发率约为 15%-30% [1]。
鉴别诊断列表
最终诊断
最终的组织学诊断为皮样型纤维瘤病。
图像分析
术前重新评估CT

腹壁肿块的 CT 表现

腹壁肿块的超声表现
医学影像分析报告
一、影像学发现
根据所提供的腹部CT及超声影像资料,可见右侧腹壁(外侧中段)存在一枚边界相对清楚的软组织肿物。该肿物在CT上密度与或略高于周边肌肉组织,内部无明显坏死或钙化表现,增强后可见轻至中度强化;超声下可见较均匀或局部回声改变,局部可见“筋膜尾征”及“鹿角状延伸征”,提示肿瘤有沿肌筋膜或肌束指状延伸的特征。肿物位置深浅适中,与周围腹壁肌层关系密切,但尚无明显累及腹腔内器官的征象。
二、潜在诊断
基于患者年龄、临床表现和影像学所见,考虑以下潜在诊断:
- 腹壁型硬纤维瘤(Desmoid-type fibromatosis)
特点:常见于育龄期女性,多为无痛、缓慢生长的肿块;影像学可表现为边界清,但有指状延伸,无远处转移倾向。 - 腹壁其他良性软组织肿瘤(如脂肪瘤、纤维瘤等)
特点:脂肪瘤通常CT表现为脂肪密度,纤维瘤多为均匀软组织密度,强化程度较轻。根据现有资料,影像特征更倾向于硬纤维瘤,但仍可考虑鉴别。 - 腹壁转移性肿瘤
特点:通常患者可能有外科手术史或其他肿瘤原发灶;本例患者无手术史或明显原发肿瘤,因此转移性病变可能性较小。
三、最终诊断
结合患者的性别、年龄、无痛缓慢生长的特征,影像学表现(边界尚清、轻中度强化、支持筋膜尾征及指状肌内延伸),以及实验室检查未见特异性异常,最可能的诊断为:
腹壁型硬纤维瘤(Desmoid-type fibromatosis)
若需进一步明确诊断,建议进行核心针穿刺活检或手术病理检查,以作出最终的组织学诊断。
四、治疗方案与康复计划
对于已确诊的腹壁型硬纤维瘤,治疗策略一般取决于肿瘤的大小、部位以及患者症状:
- 保守/观察治疗:对于生长缓慢、症状轻微或无功能受损的病例,可选择密切随访,定期复查影像学以监测肿瘤变化。
- 手术切除:对于进行性增大、引起疼痛或功能障碍以及影响美观或生活质量的肿瘤,可考虑手术。手术需保证充分切缘,以降低局部复发率。
- 药物治疗:对于无法手术切除或复发风险高者,可考虑使用激素、NSAIDs 或靶向治疗(如酪氨酸激酶抑制剂)等保守性药物方案。
康复及运动处方建议:
由于腹壁肌肉在躯干稳定中作用明显,术后或保守治疗时均需科学制定康复运动计划,以维持和增强核心肌群张力,并避免过度牵拉致再次损伤。
- 初始阶段(术后或确诊早期):
· 以基础呼吸运动、核心稳定性练习为主(如仰卧位收腹呼吸、骨盆后倾练习等)。
· 低强度,小范围活动,每次约10–15分钟,每天1–2次。 - 中级阶段(伤口愈合或症状缓解后):
· 渐进性增加核心力量训练,如小范围卷腹、桥式运动(桥式时注意避免过度牵拉腹壁)。
· 强度可逐渐提高至中等水平,每次15–20分钟,每周3–4次,视恢复情况调整。 - 后期阶段(恢复期或长期维持):
· 加强全身性耐力和力量训练,如轻度哑铃训练、普拉提或瑜伽等。
· 运动时间可延长至每次20–30分钟,每周3–5次,同时注意控制动作幅度,以保护腹壁肌群。
在整个康复过程中,应遵循“FITT-VP(频率、强度、时间、类型、进度与个体化)”原则,密切观察腹壁有无再次疼痛、肿胀或其他不适。如出现异常,应及时就医评估。
免责声明:本报告为基于现有资料的参考性分析,不能替代线下面诊或专业医生的诊断与治疗意见。若有任何疑问或症状加重,请及时咨询专科医生。
人类医生最终诊断
最终的组织学诊断为皮样型纤维瘤病。