一种罕见的踝关节软组织肉瘤病例:“在皮肤下悄然蔓延”



临床病史
一名63岁的女性患者右踝部肿胀1年,逐渐增大。既往曾因类似症状在右踝部接受过手术。无其他合并症。
影像学表现
普通前后位及侧位 X 线片显示在右踝后内侧有一个边界不清的软组织病变。
超声检查结合彩色多普勒研究显示一个边界不清的混合回声病灶,内部血管丰富。
非增强计算机断层扫描(NCCT) 显示在右踝后内侧的皮下平面内可见一个分叶状、界限清晰、密度与周围组织相似的病灶,大小约 5.3 x 3.5 x 1.7 cm(头尾径 × 前后径 × 横径)。该病灶从胫骨远端干骺端水平一直延伸至距胫关节水平,约位于跟腱附着点上方 3.5 cm 处。病灶内部未见钙化或出血征象。邻近骨骼外观正常。
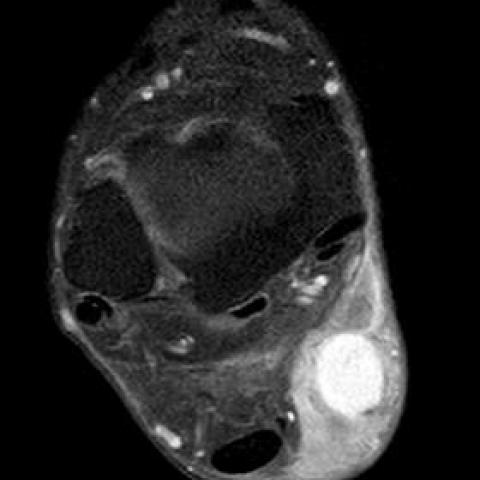
增强 MRI 显示该病灶在 T1WI 上呈等信号,在 T2WI/STIR 序列上呈高信号。T2WI 上可见少量血流空白区。病灶显示真正的弥散受限,无梯度回波伪影。周围皮下组织表现出弥漫性水肿。增强后成像显示病灶明显的异质性强化。未见明显侵犯表皮,但可见对皮下脂肪组织的侵及。
病情讨论
A. 背景
皮肤隆突性皮肤纤维肉瘤 (DFSP) 是一种罕见、低度、局部侵袭性的肿瘤,约占软组织肉瘤的6%。DFSP被归类为成纤维细胞/肌成纤维细胞肿瘤。[1] 组织学上,DFSP由均匀的梭形细胞组成,这些细胞具有细长的细胞核,呈交织束状或车轮状分布,包埋于不同比例的胶原中。免疫组化检测中,90%的DFSP患者CD34阳性。[9]
B. 临床视角
DFSP在20至50岁的成人中更常见。[1] 无明显性别差异。[2] DFSP可发生于身体的几乎任何部位,最常见部位是躯干,其次是近端肢体;头颈部较少见。[1,2] DFSP生长缓慢,可持续数月至数年。 [1] DSFP常表现为圆形、椭圆形或不规则形软组织肿物,并在不同程度上突出皮肤表面。肿瘤通常是单发的,而复发病例往往表现为分叶状或多个结节。
C. 影像学视角
在超声上,DFSP表现为低回声肿块并伴有丰富的血供。[3, 4] 在CT上,DFSP表现为单发、边界清晰的等密度皮肤或皮下肿块,无钙化。对于小肿瘤,DFSP表现为均匀强化,大肿瘤则表现为不均匀强化。[5–7].
在MRI上,该肿瘤在T1加权像上显示与肌肉等信号,在T2加权像上显示高信号。在对比增强T1加权像上,肿瘤表现为中度或明显的均匀或不均匀强化。[3, 8-9] DFSP通常血供丰富。[4, 5]
在Garg等人[5]的报道中,一例位于腿部的DFSP显示连续浸润了下方骨组织。在Thornton等人[8]的另一篇报道中,有5例中的2例根据MR成像所发现的情况扩大了拟定的手术切缘。术前MRI对于手术方案制定和随访非常重要。
D. 预后
DFSP的预后总体良好。外科切除是DFSP的主要治疗方法。然而,DFSP局部复发率较高,但远处转移少见。[5] 术后随访尤为重要,特别是在术后前三年。[11]
E. 要点提示
DFSP在平扫CT/MR上表现为皮下边界清晰的软组织小结节或肿块,在增强CT/MR上表现为中度到显著的强化。DFSP的影像学表现缺乏特异性,但在合适的临床背景下可以作出诊断。
鉴别诊断列表
最终诊断
右踝后内侧的隆突性皮肤纤维肉瘤
图像分析
目前没有可供翻译的英文内容。请提供需要翻译的文本。


(没有可翻译的英文内容。)

未检测到任何可翻译的英文内容。请提供需要翻译的英文文本。



没有可翻译的英文内容



没有可翻译的英文内容。

没有可翻译的英文内容。


(无内容可翻译)


医学影像分析报告
1. 影像学发现
基于患者提供的右踝部影像(包括X线、彩色多普勒超声、CT及MRI)可见:
- X线平片:踝关节骨质形态整体尚可,可见软组织肿块影突起,大体边缘清晰,未见明显骨性破坏或骨质侵蚀。踝关节间隙基本维持。
- 彩超:于踝关节及其周围皮下软组织层可见一低回声或混合回声肿块,探及丰富血流信号,提示局部血供较丰富。
- CT扫描:右踝皮下见边界较清晰的软组织密度影,密度大致与周围软组织相似;增强后可见中度至明显强化,局部可见分叶,暂未发现明显骨质侵蚀。
- MRI:肿块于T1加权像上信号近似于肌肉等信号,T2加权像上呈高信号,增强扫描后可见明显不均匀或相对均匀强化,符合纤维肉瘤样或相关软组织肿瘤的表现。无明显关节腔内累及,周围肌肉及肌腱偶可见受压或轻度推移。
2. 潜在诊断
综合患者年龄(63岁)、临床表现(踝部缓慢生长的肿物,局部曾行手术史)及影像学表现,潜在诊断或鉴别诊断考虑:
- 皮肤纤维肉瘤(Dermatofibrosarcoma protuberans,DFSP):典型表现为缓慢生长的皮下或软组织肿瘤,MRI常示T1等信号、T2高信号,增强明显;可有高复发率,结合本例有CD34阳性的免疫组化结果,极具诊断意义。
- 纤维肉瘤或其他纤维源性软组织肿瘤:类似的组织学表现与影像强化特征,但一般需结合病理免疫组化(如CD34、S-100等)加以区分。
- 滑膜肉瘤等软组织肉瘤:也可表现为软组织内增强肿块,但常见于较年轻的患者,且病理标记物和临床表现稍有不同。
- 巨大色素痣或其他皮肤附属器肿瘤:若仅凭影像难以完全排除,但其影像学特征常缺乏明显的血流丰富或纤维成分,组织学则容易鉴别。
3. 最终诊断
结合患者临床病史(含曾有类似手术史、肿物生长缓慢而局部复发)、影像学表现(皮下瘤样病变、T2高信号、增强扫描显著强化)以及病理组织学所示的典型纺锤形细胞“车轮状(storiform)”排列、免疫组织化学CD34阳性等特征,最可能的诊断为:
皮肤纤维肉瘤(Dermatofibrosarcoma protuberans,DFSP)。
若临床有进一步疑问,可在术中或术后追加病理分子检测(如PDGFB基因重排)以进一步明确诊断。
4. 治疗方案与康复计划
- 治疗策略:
- 手术切除:DFSP以局部侵犯性生长为特点,首选广泛手术切除(包括Mohs显微外科手术)以减少局部复发风险。尽量保持足踝关节功能,必要时术前可结合MRI评估切缘。
- 放射治疗:术后若出现切缘不清或无法达成充分安全边界时,可考虑辅以放射治疗。
- 分子靶向治疗:对于难以手术或复发病例,可考虑酪氨酸激酶抑制剂(如伊马替尼),但主要用于局部无法彻底切除或远处转移时。
- 康复与运动处方建议:
-
术后/治疗后急性期(0-2周):
- 保护患侧踝关节,避免大负荷或过度屈伸运动。
- 可进行足趾轻度活动及踝关节无负重范围内的主动活动,促进血液循环。
-
恢复期(2-6周):
- 在逐步拆除或减少外部支撑的基础上,根据医嘱进行踝关节屈伸训练。
- 日常训练可采用“低强度、高重复”的原理,起始时每次1-2组,每组10-15次,强度较轻。
-
后期功能训练(6周后至3个月):
- 逐步增加关节活动度与肌力训练,比如踮脚练习、踝关节跖屈/背屈及内翻/外翻阻力训练。
- 可持续2-3组每次,每组不限于10-15次,但需在不引起明显疼痛或肿胀的条件下循序渐进。
-
维持期(3个月及以后):
- 进行更高水平的力量和平衡训练,如单腿站立、平衡板及弹力带练习。
- 根据心肺功能与骨骼情况,可适度增加低冲击性有氧运动(如骑车、游泳等),每周2-3次,每次20-30分钟。
-
注意事项:
- 因患者年龄较大,要注重骨质情况及心肺功能评估,避免过度训练引发其他并发症。
- 每次运动前后做好足踝热身及拉伸,若出现明确疼痛、肿胀或不适需及时复诊。
免责声明:本报告仅作为医学信息参考,不能替代线下面诊或专业医生的诊断与治疗意见。具体治疗方案和康复安排请结合临床实际情况,并在专业医生指导下执行。
人类医生最终诊断
右踝后内侧的隆突性皮肤纤维肉瘤