骨性卡波西肉瘤



临床病史
HIV阳性患者伴有溶骨性病变。
影像学表现
该患者已HIV阳性8年,并患皮肤性卡波西肉瘤6年,接受了化疗(ABV-HCG)和放射治疗(3500拉德)。病变位于胸部、左臂、左大腿及左小腿。2000年5月,皮肤病变恶化,患者左臂肘部出现红肿并伴有疼痛。X线显示尺骨有大面积溶骨性病变,因此开始进行区域性放疗和全身化疗。
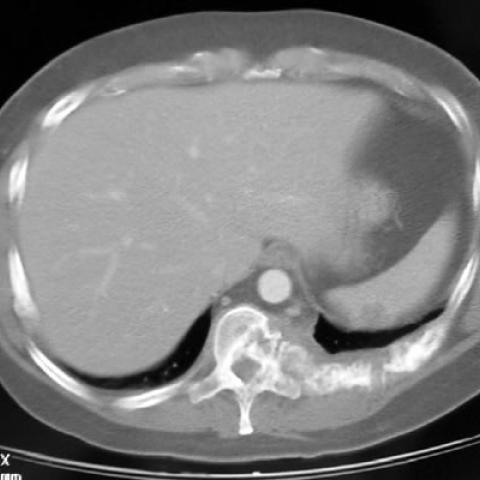
2001年9月,患者出现右侧胸痛。胸部双期CT检查显示,胸腔后壁有一大片软组织肿块,伴有相邻肋骨和椎体的溶骨性病变,并向椎管内延伸。在胸壁右侧及胸骨左侧可见卵圆形溶骨性病变,伴有软组织肿块。纵隔及腋窝淋巴结肿大,尤其以左侧为甚。CT还显示,在骶骨右侧及髂臼区亦存在溶骨性病变并伴有软组织肿块。
2001年10月,在CT引导下对肿块进行粗针活检,病理解剖结果为“卡波西肉瘤”。随后开始了相应的治疗。
2002年2月,为评估患者对治疗的反应,进行了胸部和腹部CT检查。结果显示,肋骨和椎体的溶骨性病变较前有所缩小,纵隔和腋窝的淋巴结也有所缩小。而骶骨的溶骨性病变无明显变化。
病情讨论
卡波西肉瘤(Kaposi's sarcoma,简称 KS)是一种多灶性肿瘤,被认为起源于淋巴内皮细胞。从组织学角度来看,KS 的特点是梭形细胞和裂隙状血管结构增生。它是 HIV 阳性患者中最常见的肿瘤,通常具有侵袭性,可累及多个器官,尽管骨骼疾病十分罕见。骨骼受累最常见的形式是由邻近皮肤病变(浸润性皮肤或黏膜 KS)侵入骨骼。而不累及表面皮肤的原发性骨病变则极为罕见。
从影像学角度来看,骨骼 KS 可表现为骨膜反应、皮质侵蚀或溶骨性病变。最典型的是不规则的皮质侵蚀,可能与 KS 起源于骨皮质或骨膜有关。侵蚀也可继发于周围软组织结节施加的外部压力,但在这种情况下病变多呈平滑外观。溶骨性病变可表现为均匀稀疏、囊性病变,或几乎完全的骨质破坏。也有少数报道显示可出现仅有极少成骨活性的新的骨形成。这些病变可能与 KS 细胞产生并释放诸如白细胞介素-1和白细胞介素-6等细胞因子有关,这些因子可部分通过促进破骨细胞的生成和功能来刺激骨吸收。此外,随着 KS 结节的增大所产生的压力还可以诱导当地单核细胞产生细胞因子,从而激活破骨细胞。
CT 扫描可更精确地识别溶骨性病变,MR 成像则可显示类似于淋巴瘤或感染的骨髓异常。与 CT 扫描相比,MR 成像更易于识别软组织肿块。核医学检查对进一步评估可能有帮助。使用锝 99m MDP 扫描可在皮肤病变处观察到红细胞聚集。结合铊-201与镓-67成像,可见铊-201具有特征性的摄取,而镓-67则无明显摄取。感染和其他肿瘤(如淋巴瘤)通常会摄取镓。不过,确诊仍可能需要活检。
鉴别诊断列表
最终诊断
骨性卡波西肉瘤
证书
没有可翻译的文本。
图像分析
骨性卡波西肉瘤




医学分析报告
一、影像学发现
基于所提供的胸腹部CT图像及患者信息,可见以下影像学特点:
- 骨质破坏:在部分胸椎或肋骨区域可见骨质密度减低,呈现局灶性或斑片状的溶骨性改变(osteolytic lesion)。
- 局部可见轻度骨皮质侵蚀或不规则性缺损,提示病变有向骨皮质外扩张的趋势。
- 周围软组织可能存在肿块或结节状改变,但部分病灶累及范围并无明显皮肤或粘膜病灶提示。
- 在部分影像切面上,可见邻近软组织密度增高或软组织肿胀,伴有可疑血管结构增生。
- 未见明显的骨折线,尚无明显骨折移位征象。
二、潜在诊断
结合患者为HIV感染阳性、出现溶骨性病变,以及影像学特征,考虑下列鉴别诊断:
- 卡波西肉瘤(Kaposi's Sarcoma):对于HIV阳性患者而言,卡波西肉瘤是最常见的恶性肿瘤之一,虽然骨骼受累并不常见,但可以出现骨皮质侵蚀、溶骨性病灶或软组织肿块。影像学上常表现为不规则的骨质破坏,伴或不伴邻近软组织病变。
- 骨淋巴瘤或其他恶性肿瘤:在免疫功能低下背景下,非霍奇金淋巴瘤等也可出现骨骼侵袭,表现为骨质破坏或溶骨性改变。
- 感染性骨病(例如结核或真菌感染):对于HIV患者,应考虑机会性感染。结核或深部真菌感染导致慢性骨髓炎时,也会有破坏性病变,需要影像与实验室检测进一步鉴别。
三、最终诊断
在综合该患者的年龄、HIV阳性背景、典型的溶骨性病变以及影像学特征后,最可能的诊断为 卡波西肉瘤(Kaposi's Sarcoma)累及骨骼。由于骨受累的卡波西肉瘤较为少见,若影像学、临床表现仍有疑问,可考虑行病理学穿刺或活检以确诊。
四、治疗方案与康复计划
1. 治疗策略
- 抗逆转录病毒治疗(ART):积极控制HIV病毒载量,改善机体免疫功能,对延缓卡波西肉瘤进展至关重要。
- 局部治疗:若病灶局限且引起明显症状,可在专科医生评估后考虑放疗或局部注射治疗,帮助减轻骨痛或局部破坏。
- 全身治疗:对于广泛累及多处骨骼或其他器官的卡波西肉瘤,可考虑化疗(如含紫杉醇、蒽环类药物的方案)或使用特异性治疗药物,如α-干扰素,与ART联合。
- 对症处理:如有骨痛,应给予适当镇痛及补钙、维生素D等支持治疗,以减轻症状并促进骨骼健康。
2. 康复/运动处方建议
基于患者HIV感染背景、可能存在的骨质破坏情况,康复训练方案需个体化制定,循序渐进,并注重安全性。
- 早期康复:
- 以低强度的有氧运动为主,如日常步行、踏车训练或坐姿划船等,每次持续10–15分钟,每周3–4次。
- 若出现疼痛或疲劳,可适当减少运动强度与时长。
- 进行简单的关节活动度练习和轻度抗阻训练,重点关注姿势稳定性和肌群协调性。
- 中期康复:
- 在体能允许的情况下,逐步增加有氧运动总时间至20–30分钟/次,每周3–5次。
- 轻度抗阻训练可增加到中等强度(如使用小重量哑铃或弹力带),每组10–12次,提高肌力及骨骼支撑能力。
- 密切监测骨痛或局部不适,确保无过度负重。
- 后期康复:
- 当病情稳定且骨损伤风险降低后,可尝试加入如太极拳、瑜伽等中低冲击运动,进一步改善平衡能力和肌肉耐力。
- 根据医生和康复治疗师评估,若骨骼状况允许,可逐渐增加抗阻和有氧训练的强度。
- 保持定期复查和医学评估,关注HIV病毒载量、血液学指标及骨健康状况。
以上运动方案遵循FITT-VP原则:从频率(Frequency)、强度(Intensity)、时间(Time)、类型(Type)、进度(Progression)以及体积(Volume)逐步调整。对于骨质脆弱或免疫力较低的患者,应确保安全性,在专业人员指导下进行。
免责声明:
本报告为基于有限影像与病史信息的参考性分析,不可替代面对面诊疗或专业医师意见。若有任何进一步疑问或症状,请及时就诊并听取专科医师的建议。
人类医生最终诊断
骨性卡波西肉瘤